Calcolatore per la Legge di Lambert-Beer
Indice
Cos'è la legge di Lambert-Beer?Equazione della legge di Lambert-BeerCome usare il calcolatore per la legge di Lambert-BeerConversione dell'assorbanza in trasmittanzaApplicazioni della legge di Lambert-BeerFAQIl calcolatore per la legge di Lambert-Beer di Omni ti permette di calcolare l'assorbanza (o attenuazione) della luce al suo passaggio attraverso qualsiasi materiale e per determinare la concentrazione molare delle soluzioni.
Cos'è la legge di Lambert-Beer?
fornisce una relazione tra la concentrazione di una soluzione e l'attenuazione della luce che attraversa la soluzione.
La legge di Beer afferma che quando un fascio di radiazioni elettromagnetiche attraversa un campione (solitamente una soluzione), la sua assorbanza dipende dalla concentrazione del campione e dalla lunghezza del percorso del fascio nel campione.
Se vuoi, puoi consultare il nostro calcolatore per la concentrazione per convertire la molarità di una sostanza in concentrazione percentuale.
Equazione della legge di Lambert-Beer
Per capire l'assorbanza, consideriamo la figura 1. Un raggio di luce di intensità attraversa una soluzione posta in un contenitore di diametro .
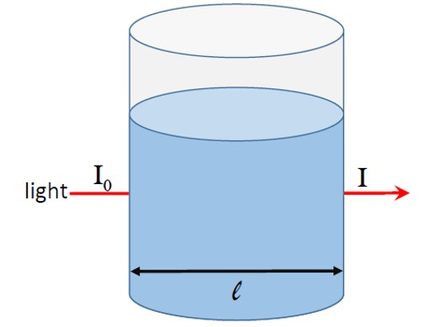
Se la soluzione assorbe la luce, l'intensità della luce che emerge dal contenitore sarà inferiore a . Se l'intensità della luce trasmessa è , possiamo definire l'assorbanza come:
Possiamo esprimere l'equazione della legge di Beer come:
dove:
- — Coefficiente di assorbimento molare o molarità;
- — Lunghezza del percorso del fascio nel campione; e
- — Concentrazione della soluzione.
In spettroscopia, la lunghezza del percorso è solitamente espressa in cm e l'assorbanza è senza unità (una quantità senza dimensioni). L'unità di misura per esprimere la concentrazione della soluzione del campione è mol/L e quindi l'unità di misura dell'assorbanza molare è L/(mol·cm).
Ti consigliamo di provare il nostro calcolatore per la molarità. Ti aiuta a convertire la concentrazione di massa di qualsiasi soluzione in concentrazione molare.
Come usare il calcolatore per la legge di Lambert-Beer
Vediamo come si usa il calcolatore per la legge di Beer per calcolare l'assorbanza della luce da parte di una soluzione di concentrazione molare . La lunghezza del percorso è e l'assorbanza molare è .
- Inserisci il valore del coefficiente di assorbimento molare, cioè ;
- Digita la concentrazione della soluzione, cioè ;
- Inserisci la lunghezza del percorso, cioè ;
- Il calcolatore visualizzerà l'assorbanza: ; e
- Puoi utilizzare questo calcolatore per la legge di Lambert-Beer anche come convertitore di trasmittanza in assorbanza. Basta inserire i valori di trasmittanza in percentuale per ottenere l'assorbanza.
Conversione dell'assorbanza in trasmittanza
Nella figura 1, la frazione di luce che passa attraverso il campione dà la trasmittanza T, ovvero:
...e possiamo esprimere la relazione tra trasmittanza e assorbanza come:
Come abbiamo notato, la relazione tra assorbanza e trasmittanza è logaritmica. Un'assorbanza di 0 implica una trasmittanza del 100%.
Nelle tecniche di spettrofotometria, misuriamo l'intensità della radiazione che entra nella soluzione campione e l'intensità della radiazione che ne esce. Utilizziamo quindi le due intensità per calcolare i valori di trasmittanza o assorbanza.
Applicazioni della legge di Lambert-Beer
La maggior parte delle tecniche di analisi spettroscopica in chimica si basa sulla legge di Lambert-Beer. Alcune applicazioni comuni della legge di Beer nella chimica analita sono:
- Determinare la concentrazione dei campioni misurando l'assorbanza; e
- Determinare l'identità di una sostanza sconosciuta determinandone la molarità.
Abbiamo uno strumento che ti aiuta a calcolare le proporzioni di due soluzioni da miscelare per produrre una soluzione richiesta con una concentrazione specifica, il calcolatore per l'alligazione 🇺🇸.
Qual è l'unità di misura dell'assorbanza nella legge di Lambert-Beer?
L'assorbanza è una quantità senza unità. Si tratta del rapporto tra l'intensità della luce incidente e quella della luce trasmessa; pertanto, è adimensionale e non ha unità. Tuttavia, a volte l'assorbanza viene riportata in unità di assorbanza (AU).
Come si calcola l'assorbenza molare dalla legge di Beer?
Per calcolare l'assorbenza molare dalla legge di Beer, procedi come segue:
- Moltiplica la lunghezza del percorso con la concentrazione molare della soluzione;
- Dividi l'assorbanza per il valore ottenuto al punto 1; e
- Congratulazioni! Hai calcolato con successo l'assorbanza molare dalla legge di Beer.
Come si calcola la concentrazione a partire dall'assorbanza nella legge di Beer?
La legge di Lambert-Beer viene spesso utilizzata per determinare la concentrazione delle soluzioni. Per calcolare la concentrazione di una soluzione in base alla legge di Beer, segui le istruzioni fornite:
- Determina l'assorbanza al passaggio della luce di una determinata lunghezza d'onda attraverso la soluzione;
- Trova la lunghezza del percorso che la luce deve percorrere;
- Moltiplica il coefficiente di assorbimento molare con la lunghezza del percorso; e
- Dividi l'assorbanza per il valore ottenuto al punto 3 e otterrai la concentrazione della soluzione.
Come si calcola la trasmittanza dall'assorbanza?
Per calcolare la trasmittanza dall'assorbanza, dobbiamo seguire i passi indicati:
- Sottrai il valore di assorbanza dal numero 2;
- Prendi l'antilogaritmo del valore ottenuto al punto 1 e otterrai la percentuale di trasmittanza; e
- Puoi anche utilizzare il nostro calcolatore per la legge di Lambert-Beer per calcolare la trasmittanza.
